Lebensretter identifiziert
Mechanismen der initialen Blutgerinnung aufgedeckt
14.05.2007, Press releases
Physikern der TU München und der Universität Augsburg ist es gemeinsam mit Medizinern der Universität Münster gelungen, das Rätsel der initialen Blutgerinnung zu lösen. Die Zusammenarbeit liefert fundamental neue Einsichten, die Gefäßkrankheiten, wie z. B. die Arteriosklerose, in einem neuen, medizinisch-physikalischen Licht erscheinen lassen und die Grundlage zu neuartigen Therapieansätzen bilden werden. Dies verstärkt die Hoffnungen, die von-Willebrand-Erkrankung als häufigste Erbkrankheit therapieren zu können. Der Kooperation verschiedener Forscher in unterschiedlichen Disziplinen im Exzellenz-Cluster "Nanosystems Initiative Munich" (NIM) führte zu diesem Bahn brechenden Erfolg.
Bisher war auch nach Jahren intensiver Forschung die Blutgerinnung immer noch ein großes Rätsel der Medizin. Ausschlaggebend für den Verschluß von Verletzungen in Blutgefäßen ist die Aktivierung des von-Willebrand-Faktors (vWF), eines Proteins, das als Trägerprotein eine wichtige Rolle bei der Blutstillung spielt. Ohne diese Funktion würde auch die kleinste äußere Verletzung unweigerlich zum Tode durch Verbluten führen.
Der vWF wird von den Endothelzellen gebildet, die die Innenwand eines Blutgefäßes (die Intima) bilden. Kommt es zu einem Riss dieser Innenwand, werden die darunter liegenden Proteine der Gefäßwand freigelegt. An diese kann der von-Willebrand-Faktor binden. Bestimmte zelluläre Elemente des Blutes, die Blutplättchen (Thrombozyten), verfügen auf ihrer Oberfläche über eine Andockstelle, an die der von-Willebrand-Faktor binden kann. Der vWF schafft also eine Brücke zwischen den Blutplättchen und der verletzten Gefäßwand. Doch die Frage, wie es zur Anheftung an die Gefäßwand kommt und damit zum Verschluß einer Verletzung, blieb bislang ungeklärt.
Darüber hinaus lassen Untersuchungen erkennen, dass die Anhaftung bei hohen Strömungsgeschwindigkeiten effektiver funktionierte als bei niedrigen – für den menschlichen Organismus absolut lebensnotwendig, denn durch den im Herzen erzeugten Blutdruck wird gerade in kleineren Gefäßen - z. B. in den Arteriolen – eine weitaus höhere Scherrate als in großen Gefäßen erzeugt. Diese hohe Scherrate setzt Gefäßwände einer hohen mechanischen Belastung aus, die die Bildung von Verletzungen und Rissen begünstigt. Tatsächlich ist der vWF gerade dort besonders "fleißig" und effektiv. Das Rätsel, weshalb der vWF gerade bei hohen Strömungsgeschwindigkeiten besonders effektiv wirkt, scheint nun gelöst
Der vWF als "mechanisch schaltbares" Molekül
Bisherige Untersuchungen stellten enzymatische und biochemische Aspekte in ihr Zentrum. Offensichtlich sind bei der Aktivierung des vWF aber mechanische Kräfte am Werk, große Scherkräfte nämlich, die bei hohen Strömungsgeschwindigkeiten - also unter Bedingungen, wie sie in den Arteriolen des menschlichen Blutkreislaufes herrschen - wirksam sind. Insofern mussten sich Wissenschaftler verschiedener Disziplinen zusammentun, um Fortschritte bei der Erforschung des Phänomens zu erzielen. Solch ein entscheidender Fortschritt hat sich nun aus der Zusammenarbeit der Physiker-Arbeitsgruppen der TU München und der Universität Augsburg einerseits mit Medizinern aus Münster andererseits ergeben, die der im Rahmen der Exzellenzinitiative des Bundes geförderten "Nanosystems Initiative Munich" (TUM und LMU München) angehören.
Strömungssimulation im Computer
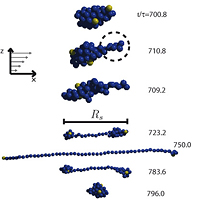
Die Arbeitshypothese am Anfang war, dass das ungefähr kugelförmige vWF Protein durch die Scherkräfte entfaltet wird, und dadurch die spezifischen Bindungsgruppen überhaupt erst an die Gefäßwand andocken können. Die Verformung eines kugelförmigen weichen Objekts in einer Strömung ist ein klassisches Problem der Strömungsdynamik und Beispiel einer Reihe von so genannten hydrodynamischen Instabilitäten, wie sie im Alltag und der Technik eine wichtige Rolle spielen. So beschreibt die Kelvin-Helmholtz-Instabilität das Verwirbeln zweier paralleler Flüssigkeits- oder Gasströmungen entgegengesetzter Richtung. Dieser Effekt trägt zur Wolkenbildung und zum Wettergeschehen auf der Erde bei. Ein anderes anschauliches Beispiel liefern Wellen auf einem See bei Wind oder der sich kräuselnde Rauch eines Räucherstäbchens in einem ansonsten ruhigen Zimmer. In dem hier behandelten Beispiel eines Proteins liegen die Größenskalen allerdings auf der Nanometer-Skala, und tatsächlich werden für Instabilitäten im Nanobereich, anders als im makroskopischen Bereich, thermische Anregungen relevant. An dieser Stelle wurden die Computersimulationen von Dr. Alfredo Alexander-Katz für das Forschungsprojekt sehr wichtig, der finanziert durch ein Stipendium der amerikanischen National Science Foundation (NSF) zwei Jahre am Lehrstuhl für Weiche Materie von Prof. Roland Netz gearbeitet hat. In seinen Simulationen konnte Dr. Alexander-Katz zeigen, dass die Entfaltung eines Proteins mit einer so genannten Protrusion (Verschiebung) startet: das ist eine kleines Stück des fadenförmigen Proteins, das aus der kugelförmigen Faltungsstruktur herausschaut. Dies ist in der Abbildung veranschaulicht, in der zeitlich aufeinander folgende Schnappschüsse aus der Simulation gezeigt werden. Die Protrusion bildet die erste Phase der kompletten Entfaltung des Proteinmoleküls, welches in der Simulation vereinfacht durch eine Perlenkette von einander anziehenden Kugeln dargestellt ist. In der gemeinsam von Dr. Alexander-Katz und Prof. Netz erarbeiteten Theorie, die im letzten Jahr in Physical Review Letters veröffentlicht wurde, wird dieser Protrusions-induzierte Entfaltungsmechanismus entschlüsselt. Insbesondere wird vorhergesagt, dass die Größe des Proteins der entscheidende Parameter für die Entfaltung im Scherfluss ist. Um ein Protein bei den in kleinen Gefäßen üblichen Scherraten zu entfalten, muss es einen Durchmesser von einem Mikrometer haben. Die erklärt, warum der vWF so riesig ist.
Experimentelle Bestätigung
Um den Effekt der Aktivierung des von-Willebrand-Faktors experimentell zu erforschen, mussten die Wissenschaftler zunächst eine Versuchsanordnung finden, die die Bedingungen in den Blutkapillaren widerspiegelt. Dafür nutzten sie vor allem die in den letzten Jahren in Augsburg entwickelte Methode des so genannten "Chip Labors": Auf einer Chipoberfläche mit einer Größe von einigen Millimetern wird hier unter Nutzung von akustischen Oberflächenwellen ("Nanoerdbeben") eine Strömung in einem nur wenige Mikrometer breiten Kanal erzeugt. Bei den in diesem "Chip Labor" erzeugten verschiedenen Strömungsgeschwindigkeiten ergab die Beobachtung des von-Willebrand-Faktors Erstaunliches: Sehr hohe Fließgeschwindigkeiten führen dazu, dass der vWF plötzlich seine Form ändert und von einer ca. 2 Mikrometer großen Kugel zu einem 100 Mikrometer langen Faden wird, genau wie mit Hilfe der theoretischen Modelle in computergestützten Simulationen vorhergesagt. Durch diese Entfaltung werden Bindungsstellen zur Verfügung gestellt, die vorher im Inneren der Kugel lagen. Mit diesen Bindungsstellen kann der vWF nun sehr effektiv an verschiedene Eiweiße, z. B. an Kollagene, der verletzten Gefäßwand anbinden. Zudem kommt es unter dauerhaft starker Strömung zur Quervernetzung von mehreren vWF-Fäden. An dieses Faser-Netzwerk können Blutplättchen leicht und verlässlich anbinden, was zur effektiven Bildung eines kleinen Blutpfropfens und damit zum Wundverschluss führt.
Der vollständige Fachartikel "Shear-induced unfolding triggers adhesion of von Willebrand factor fibers", in dem S. W. Schneider, S. Nuschele, A. Wixforth, C. Gorzelanny, A. Alexander-Katz, R. R. Netz und M. F. Schneider ihre einschlägigen Untersuchungen und deren Ergebnisse beschreiben, ist am 8. Mai in der US-amerikanischen Zeitschrift "Proceedings of the National Academy of Sciences" (PNAS) erschienen. Die PNAS zählen zu den weltweit angesehensten Zeitschriften in den Naturwissenschaften.
Weitere Informationen:
http://einrichtungen.physik.tu-muenchen.de/T37/- Arbeitsgruppe TU München
http://www.nano-initiative-munich.de/- Nanosystems Initiative Munich
Kontakt:
Technische Universität München
Lehrstuhl für Physik II (T37, Theoretische Physik)
Prof. Dr. Roland Netz
James-Franck-Straße, 85747 Garching
Telefon: 089-289-12394, E-Mail: netz@ph.tum.de
Kontakt: presse@tum.de
More Information
http://einrichtungen.physik.tu-muenchen.de/T37/